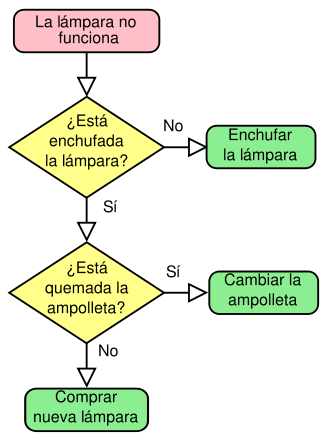
La llei periòdica és el fonament de la taula periòdica dels elements, tal com s'anomena al esquema universal que organitza, classifica i distribueix els diferents elements químics existents en relació amb les seves característiques i propietats.
La llei periòdica és el fonament de la taula periòdica dels elements, tal com s'anomena al esquema universal que organitza, classifica i distribueix els diferents elements químics existents en relació amb les seves característiques i propietats.
Base sobre la qual s'assenta la taula periòdica dels elements
Mentrestant, la llei periòdica disposa que les propietats físiques i químiques dels esmentats elements s'inclinin a la repetició sistemàtica conforme augmenta el nombre atòmic dels elements.
Taula periòdica: organització dels elements químics en ordre creixent a la quantitat d'àtoms de què disposa cadascú
La taula tan famosa dels elements que estudiem a l'escola, en les matèries de física i de química, és un esquema que s'ocupa d'ordenar els elements químics d'acord amb el seu ordre creixent en matèria de quantitat d'àtoms.
Les columnes verticals de la taula s'anomenen grups i conté els elements amb igual valència atòmica i que per tant tenen propietats símils, mentre que a les files horitzontals, anomenades com a períodes, s'agrupen els elements amb propietats diferents però que tenen masses similars.
Com es va avançar en aquest coneixement: esdeveniments puntuals i graduals
Cal destacar que tots aquests conceptes inherents a la física ia la química es van anar desenvolupant de manera gradual i progressiva durant el segle XIX.
Hem de dir que alguns elements com la plata (Ag), l'or (Au), el coure (Cu), el plom (Pb) i el mercuri (Hg) ja disposaven d'un perfecte coneixement des de l'antiguitat, el primer descobriment científic d'un element va succeir durant el transcurs del segle XVII, quan l'alquimista Henning Brand va identificar per primer cop l'element fòsfor (P).
Al segle següent, o sigui, al XVIII es van començar a conèixer nous elements, sent els més rellevants els gasos, gràcies al desenvolupament de la química pneumàtica, entre ells oxigen (O), nitrogen (N) i hidrogen (H).
Per aquests temps el químic francès Antoine Lavoisier va escriure una llista de substàncies simples en què apareixien ja 33 elements.
Al començament del segle XIX la invenció de la pila elèctrica va desencadenar l'estudi de fenòmens químics nous i això va acabar generant el descobriment de més elements, com ser els metalls alcalins i els alcalins-terris.
L'any 1830 ja s'havien identificat 55 elements.
Als mitjans del segle XIX, amb la invenció d'un aparell anomenat espectroscopi es van trobar més elements, especialment aquells associats al color que presentaven les seves línies espectrals, entre ells el cesi, el tal·li i el rubidi, per nomenar-ne alguns.
L'espectroscopi és un instrument que serveix per observar i aconseguir un espectre, i aquest és el resultat d'una dispersió d'una sèrie de radiacions, de sons o fenòmens ondulatoris.
La similitud que presentaven quant a propietats químiques i físiques determinats elements va fer que alguns científics d'aquella època es decidissin a ordenar-los de manera sistemàtica, a agrupar-los seguint determinats criteris.
L'antecedent més remot que tenim de la llei que ens ocupa és la coneguda Llei de les octaves, desenvolupada pel químic anglès John Alexander Newlands, qui va proposar despertant una gran novetat, que cada vuit elements ens trobem davant de propietats símils.
Aquest va ser la puntada de peu perquè alhora formulés la seva pròpia taula periòdica publicada formalment l'any 1863.
Tal com si s'estigués en una cursa de postes, el guant en aquest sentit el va recollir un altre químic, en aquest cas el alemany Julius Lothar Meyer, qui usant com a punt de partida els resultats de Newlands, l'any 1870, va determinar els volums atòmics dels elements.
Quan va calcular els pesos atòmics i els va representar va estar en condicions de demostrar al món de la ciència la confirmació respecte que el pes atòmic implica un augment de les propietats físiques.
I gairebé en simultani als treballs de Meyer, el químic d'origen rus Dimitri Mendeléyev publica la primera taula periòdica, guanyant de mà a Meyer que ho faria un any després i per tant és qui s'ha quedat amb el mèrit de ser el seu creador.
Mendeléyev ordenaria els elements per ordre creixent en funció de la massa atòmica que presenten, mentrestant, va situar en una mateixa columna aquells que compartien alguna característica.
Val esmentar que per a aquesta època es coneixien ja 63 elements dels 90 existents.
La taula es va completar a finals del segle XIX amb un altre grup més, anomenat zero, i conformat pels gasos nobles.